细菌感染是危害人类健康的主要原因之一。革兰氏阴性菌由于具有不可渗透的外膜,它所导致的细菌感染更难被治愈,相关药物也更加匮乏。抗菌性多肽以物理作用破坏菌膜,不易产生耐药性,被称为下一代抗生素,对革兰氏阴性菌表现出优异的抗菌性能。然而,由于其最小抑菌浓度始终不能与现有抗生素相媲美,限制了抗菌性多肽的临床应用。 针对此问题,理化所生物纳米材料团队通过将抗菌性多肽偶联至一维棒状的烟草花叶病毒(TMV)外表面来提升抗菌性多肽的抗菌性能。一方面,偶联至TMV外表面之后,抗菌性多肽获得了显著提高的局部浓度;另一方面,棒状纳米粒子与菌膜的接触面积通常大于球形纳米粒子,因而对菌膜的破坏性更强。结果表明,偶联至TMV外表面的抗菌性多肽获得了数百倍提升的抗菌活性,如TAT多肽对大肠杆菌的最小抑菌浓度可由1300 μg /mL降低至3.2 μg/mL(以多肽浓度为计)。通过形貌及基因分析,抗菌性多肽功能化的TMV(Peptide-TMV)通过对膜结构的破坏以及诱导大肠杆菌产生ROS导致大肠杆菌的凋亡。同时,Peptide-TMV与大肠杆菌作用后,还将引起大肠杆菌生物膜相关基因的下调,从而抑制了生物膜的形成,抑制率约55%。该工作为大幅提升抗菌性多肽的抗菌活性提供了新的策略。
相关结果以“Conjugating Peptides onto 1D Rodlike Bionanoparticles for Enhanced Activity against Gram-Negative Bacteria”为题,发表在Nano Letters上(Nano Lett. 2021, 21, 1722-1728)。理化所在读博士生谢国成是该论文的第一作者,牛忠伟研究员及田野副研究员是该论文的通讯作者。
该研究团队近年来在基于天然大分子的抗菌材料领域取得了系列研究结果,如通过病毒衣壳蛋白与光敏剂的组装构建穿膜增强的光动力抗菌体系(Proc. Natl. Acad. Sci. U. S. A. 2019, 116, 23437-23443),通过菌膜诱导结构转变的壳聚糖-聚乙二醇-抗菌性多肽偶联物抵抗绿脓杆菌生物膜感染(ACS Appl. Mater. Interfaces 2020, 12, 13731-13738),平衡改性壳聚糖的抗菌性与安全性以促进革兰氏阳性菌感染创面的修复(J. Mater. Chem. B 2018, 6, 3884-3893),利用剪切变稀的水凝胶体系构建具有抗菌功能的3D打印生物墨水(Bioact. Mater. 2020, 5, 808-818)等等。相关研究工作得到理化所所长基金、国家重点研发计划、国家自然科学基金、北京市自然科学基金、中科院青年创新促进会的大力支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.0c04516
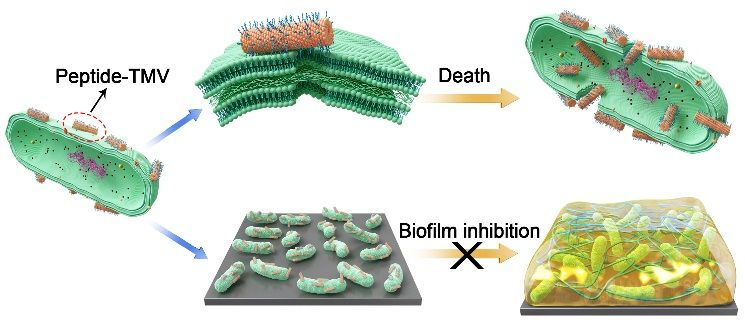
多肽功能化烟草花叶病毒抗革兰氏阴性菌及抑制生物膜形成示意图
